La mitochondrie est une organelle reconnue pour son rôle essentiel au sein des cellules eucaryotes. Sa fonction dans la respiration cellulaire est accomplie grâce à un réseau complexe de transporteur d’électrons tous associés les uns aux autres et imbriqués au sein de sa membrane interne afin de produire de l’ATP, «la devise énergétique de la cellule»1. Ses origines remontent loin, provenant d’une association symbiotique entre une cellule eucaryote et une bactérie procaryote qui aurait été phagocytée par cette première1. Des millions d’années d’évolution commune et mutualiste ont rendu ces organelles dépendantes, mais aussi indispensables aux cellules eucaryotes1. Leurs caractéristiques impressionnantes ont laissé les biologistes bouche-bée face à leur complexité fascinante.
Tout récemment, de nouvelles découvertes sur la transmission des génomes mitochondriaux, notamment chez les levures et chez certaines espèces de mollusques bivalves ont fait surface. Tout d’abord, il serait intéressant d’apprendre à mieux connaître ce fameux génome. Bien qu’il ait été mieux équipé par le passé pour subvenir aux besoins des mitochondries primitives, il est aujourd’hui beaucoup plus petit en taille à cause de nombreux transferts de gènes entre la mitochondrie et son hôte2. Ceci a eu pour effet de la rendre dépendante des cellules eucaryotes à tel point que le génome mitochondrial ne code que pour les protéines impliquées dans la respiration cellulaire2. Il existe des exceptions qui portent à croire que ce génome pourrait cacher des fonctions inédites, dont la production de l’humanine et de MOTS-c qui sont, chez l’humain, des protéines pouvant potentiellement lutter contre les maladies neurodégénératives et les effets du vieillissement, respectivement2. Il demeure tout de même un atout sans précédent: le mécanisme inhabituel de transmission du génome mitochondrial observé chez certaines levures et mollusques bivalves2,3.
À priori, les levures sont des organismes fongiques unicellulaires et ils nous sont très bénéfiques en ce qui a trait à notre gastronomie4. C’est grâce à elles que nous pouvons produire différentes variétés de pains et la grande palette de boissons alcoolisées que nous connaissons aujourd’hui4. Tout cela grâce à leur indispensable capacité de pousser dans des milieux autant aérobie que anaérobie. Les conditions anaérobiques leur permettent de produire l’éthanol qui est l’ingrédient prisé par les producteurs d’alcool5.
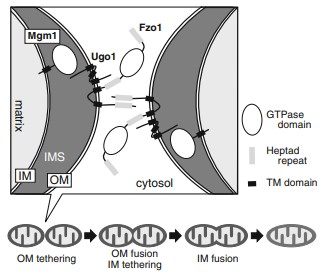
Cependant, ces organismes nous cachent une facette de leur succès reproducteur. Il existe deux types de cellules ayant différents caractères sexuels: le type a et le type α6. Chacun de ces types de cellules est haploïde, mais ils produisent des phéromones pouvant être captés par le type sexuel opposé, ce qui permet alors à ceux-ci de s’unir pour former une cellule progénitrice diploïde6. Étonnamment, et contrairement à la majorité des eucaryotes où ce sont les mitochondries maternelles qui sont héritées par la progéniture, les levures comme Saccharomyces cerevisiae possèdent un mécanisme plus complexe3.Ce mécanisme comporte une fusion des mitochondries sous le contrôle collaboratif de trois protéines, soit Fzo1, Ugo1 et Mgm13. Les deux premières sont des protéines transmembranaires de la membrane externe tandis que la dernière se situe dans la matrice avec un ancrage à la membrane interne3. Fzo1 et Mgm1 sont toutes les deux des GTPases et elles contribuent chacune à la fusion des membranes externe et interne, respectivement, en adoptant une conformation propice à ce but3. Entre autres, un parallèle peut être fait entre le mécanisme d’action de Fzo1 et celui utilisé par les protéines SNARE pour la fusion des vésicules synaptiques et leur cellule réceptrice dans les neurones3,7. Ceci permet donc à des recombinaisons homologues d’avoir lieu entre les génomes mitochondriaux des deux types sexuels3. Ultimement, ceci offre un plus grand inventaire de possibilités d’adaptation en introduisant des nouvelles séquences nucléotidiques inédites8. Serait-ce l’explication pour la versatilité métabolique de ces organismes, sans laquelle nous ne pourrions produire de délicieux aliments et boissons? Malgré le fait que la fermentation ait lieu dans le cytoplasme, un indice pour répondre à cette question serait d’élucider l’origine de la capacité qu’ont certaines levures de performer la respiration cellulaire et la fermentation conjointement dans des conditions aérobies. Ce phénomène est nommé l’effet Crabtree9,10.
À présent, il faut explorer un phénomène probablement moins connu, mais d’autant plus mystérieux, soit celui de la transmission du génome mitochondrial chez les mollusques bivalves. Ce qui les distingue de la majorité des eucaryotes est le fait qu’elles ont des mitochondries maternelles dans toutes les cellules, sauf les spermatozoïdes11.
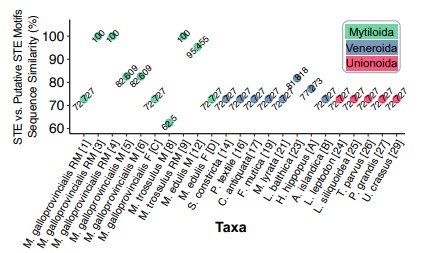
Différentes hypothèses ont été avancées pour tenter de décrire ce phénomène, dont trois qui semblent plus plausibles11. D’abord, une possibilité serait que seulement des mitochondries paternelles migrent vers les tissus destinés à produire des spermatozoïdes11. Ensuite, les deux types de mitochondries seraient présentes dans les tissus reproducteurs, mais celles paternelles ont l’avantage de dominer en nombre11. Finalement, il pourrait y avoir un mécanisme favorisant la survie des mitochondries paternelles et non celles maternelles dans les tissus concernés11. Selon une étude des mêmes auteurs qui avancent ces hypothèses, la troisième serait la plus plausible11. Entre autres, ils ont identifié des séquences dans le génome mitochondrial paternel de certaines espèces pouvant servir de signal de localisation et de spécificité aux spermatozoïdes11. L’une de ces séquences chez l’espèce Mytilus galloprovincialis est la suivante : CCATAAATGTTTGAAAATAAGG11.
Un autre groupe de chercheurs a par la suite décidé de vérifier si des séquences similaires à celle-ci pourraient potentiellement être conservées dans les génomes mitochondriaux d’espèces appartenant à d’autres groupes12. Leurs efforts ont porté fruit grâce à des méthodes d’alignement de séquences avec des régions inconnues provenant de 157 génomes mitochondriaux issus de différentes espèces de mollusques bivalves12. Ils ont constaté que des séquences apparentées à celle identifiée chez Mytilus galloprovincialis étaient également répandues chez certaines espèces dans deux autres ordres, soit Veneroida et Unionoida12. Quoique ce fait soit surprenant, il témoigne des anciennes origines évolutives de cette stratégie reproductrice, sans quoi elle n’aurait pu se répandre à si grande échelle.
On peut alors se poser deux autres questions. Quel bénéfice les mitochondries paternelles retirent d’être concentrées dans les spermatozoïdes? Et quelles propriétés les rendent aptes à occuper une telle fonction?
Pour tenter de répondre à ces questions, les scientifiques ont fait des analyses du niveau d’activité de plusieurs enzymes essentielles dans des voies métaboliques clés de la respiration cellulaire13. En faisant des comparaisons entre des espèces à transmission strictement maternel et d’autres à transmission biparentale, ils ont pu constater des différences dans les niveaux d’activité des enzymes selon le type de gamète et le mode de transmission13. Il est d’abord important de considérer que les spermatozoïdes ont une forte demande en énergie afin d’assurer leur propulsion et qu’un métabolisme oxydatif accéléré peut endommager le matériel génétique dû à la présence de dérivés nocifs de l’oxygène14. Ceci pourrait porter à croire que les spermatozoïdes d’espèces à transmission biparentale auraient un métabolisme ralenti pour préserver l’intégrité du génome mitochondrial mâle13. Cependant, les données recueillies suite aux analyses d’activité enzymatique ne confirment pas cette hypothèse avec certitude.
Par exemple, ils ont examiné des enzymes et protéines telles que la pyruvate kinase, la lactate déshydrogénase, la citrate synthase, la malate déshydrogénase, les complexes I et III mitochondriaux, la cytochrome c oxidase et la catalase qui sont impliquées dans les processus comme la glycolyse, le cycle de Krebs, la chaîne de transport d’électrons et l’élimination des molécules oxydatives toxiques13. Dans certains cas, ces protéines sont présentes en plus grand nombre ou quantité égale dans les spermatozoïdes par rapport aux ovules, mais demeurent plus catalytiquement actives dans les ovules13. Ceci indique que les spermatozoïdes ont un métabolisme oxydatif ralenti, ce qui est compatible avec une capacité atténuée de dégrader les dérivés toxiques de l’oxygène. Cependant, les indices sont toujours manquants par rapport aux facteurs régulant les disparités observées entre les concentrations et activités enzymatiques divergentes vues chez les spermatozoïdes et les ovules.
Les faits présentés ici témoignent ainsi de la grande capacité d’adaptation évolutive des mitochondries à travers le développement de différentes méthodes de propagation générationnelle ainsi qu’une grande flexibilité dans l’exécution d’activités métaboliques essentielles à leur survie. Elles sont un parfait exemple de la versatilité et la résilience des systèmes biologiques.
Sources:
- Scheffler, I.E. (2001). Mitochondria make a come back. Advanced Drug Delivery Reviews, 49, 3-26. doi: 10.1016/s0169-409x(01)00123-5.
2. Angers, A., Ouimet, P., Tsyvian-Dzyabko, A., Nock, T., et Breton, S. (2019). L’ADN mitochondrial, un potentiel codant mésestimé. Médecine sciences, 35, 46-54. doi: 10.1051/medsci/2018308.
3. Takano, H., Onoue, K., et Kawano, S. (2010). Mitochondrial fusion and inheritance of the mitochondrial genome. Journal of Plant Research, 123, 131-138. doi: 10.1007/s10265-009-0268-y.
4. Parapouli, M., Vasileiadis, A., Afendra, A.-S., et Hatziloukas, E. (2020). Saccharomyces cerevisiae and its industrial applications. AIMS Microbiology, 6(1), 1-31. doi: 10.3934/microbiol.2020001.
5. Otterstedt, K., Larsson, C., Bill, R.M., Stahlberg, A., Boles, E., Hohmann, S., et Gustafsson, L. (2004). Switching the mode of metabolism in the yeast Saccharomyces cerevisiae. EMBO reports, 5(5), 532-537. doi: 10.1038/sj.embor.7400132.
6. Dickinson, J.R. (2005). Are yeasts free-living unicellular eukaryotes?. Letters in Applied Microbiology, 41, 445-447. doi: 10.1111/j.1472-765X.2005.01798.x.
7. Bonifacino, J.S., et Glick, B.J. (2004). The Mechanisms of Vesicle Budding and Fusion. Cell, 116, 153-166. doi: 10.1016/s0092-8674(03)01079-1.
8. Stapley, J., Feulner, P.G.D., Johnston, S.E., Santure, A.W., et Smadja, C.M. (2017). Recombination: the good, the bad and the variable. Philosophical Transactions Royal Society B, 372, 1-5. doi: 10.1098/rstb.2017.0279.
9. Swart, C.W., Dithebe, K., van Wyk, P.W.J., Pohl, C.H., Swart, H.C., Coetsee, E., Lodolo, E., et Kock, J.L.F. (2013). Intracellular gas bubbles deform organelles in fermenting brewing yeasts. Journal of the Institute of Brewing, 119, 15-16. doi: 10.1002/jib.60.
10. Dashko, S., Zhou, N., Compagno, C., et Piskur, J. (2014). Why, when, and how did yeast evolve alcoholic fermentation?. FEMS Yeast Research, 14, 826-832. doi: 10.1111/1567-1364.12161.
11. Kyriakou, E., Kravariti, L., Vasilopoulos, T., Zouros, E., et Rodakis, G.C. (2015). A protein binding site in the M mitochondrial genome of Mytilus galloprovincialis may be responsible for its paternal transmission. Gene, 562, 83-94. doi: 10.1016/j.gene.2015.02.047.
12. Stewart, D.T., Robicheau, B.M., Youssef, N., Garrido-Ramos, M.A., Chase, E.E., et Breton, S. (2021). Expanding the Search for Sperm Transmission Elements in the Mitochondrial Genomes of Bivalve Mollusks. Genes, 12, 1-15. doi: 10.3390/genes12081211.
13. Bettinazzi, S., Milani, L., Blier, P.U., et Breton, S. (2021). Bioenergetic consequences of sex-specific mitochondrial DNA evolution. Proceedings of the Royal Society B, 288, 1-9. doi: 10.1098/rspb.2021.1585.
14. Ghiselli, F., Milani, L., Guerra, D., Chang, P.L., Breton, S., Nuzdhin S.V., Passamonti, M. ( 2013). Structure, Transcription, and Variability of Metazoan Mitochondrial Genome: Perspectives from an Unusual Mitochondrial Inheritance System. Genome Biology and Evolution, 5(8), 1535-1554. doi: 10.1093/gbe/evt112.