Nous avons tous déjà contemplé le ballet printanier des abeilles qui, en transportant le pollen de fleur en fleur, sont les grandes entremetteuses du règne végétal. Mais qu’advient-il après la pollinisation ? Avant de féconder un ovule, le pollen entretient un intense dialogue moléculaire avec le tissu femelle, qui fait l’objet de nombreuses recherches à l’UdeM. Comprendre ces petits « mots d’amour » permettrait en effet de décrypter la façon dont les plantes à fleurs ont évolué et se sont maintenues dans la nature. Explications.
Si les premières plantes apparues sur notre planète sont les algues, suivies par les mousses, les fougères et les conifères, ce sont les angiospermes ou plantes à fleurs qui dominent l’histoire évolutive des végétaux. Avec quelque 250 000 espèces, elles représentent en effet la majorité des plantes connues à ce jour[1]. Leur succès serait largement lié à la structure qui les distingue des autres végétaux : la fleur, qui regroupe et protège les organes reproducteurs (figures 1 et 2). Parmi ces derniers, citons d’abord les étamines, qui génèrent les grains de pollen, autrement dit les « spermatozoïdes des plantes ». À leur maturité, ces petits grains sont déplacés par les insectes pollinisateurs (ou tout simplement par le vent) à la surface de l’organe femelle de la fleur : le pistil.
Les choses ne font alors que commencer pour eux. En effet, ils ont été déposés au sommet du pistil, sur cette « piste d’atterrissage » appelée stigmate, alors que les ovules qu’ils doivent féconder sont situés à la base, dans l’ovaire. Pour résoudre ce problème, les grains de pollen germent et forment des tubes polliniques qui vont croître dans le pistil pour atteindre et féconder les ovules. Leur trajet, qui peut durer un à deux jours, est l’occasion d’un dialogue moléculaire complexe avec le tissu femelle, dont la bonne marche conditionne le succès reproductif[2]. En tentant de décrypter ces subtiles interactions, les biologistes ont reçu des plantes à fleurs plusieurs leçons de comportement amoureux, que nous nous proposons de décrire dans cet article.
Leçon no 1. Mettez vos prétendants à l’aise.
Immédiatement après la pollinisation, les grains de pollen sont arrimés à la surface du stigmate. Ce « premier baiser » est déjà marqué par des interactions cellulaires et moléculaires cruciales. Les deux partenaires mettent en effet en contact leurs sucres, lipides et protéines pour garantir la bonne adhésion du pollen. Certains pistils, comme ceux du lys, sont peu regardants quant à la qualité du mâle, tandis que d’autres, tels que ceux de la famille du chou, exigent du pollen qu’il présente une ornementation externe très précise (figure 3). Dans ce cas, la paroi du pollen est finement ciselée en un motif reconnaissable par le stigmate et propre à chaque espèce. Cette reconnaissance physique est alors doublée d’une interaction moléculaire entre de petites protéines du pollen et du stigmate[3]. La femelle peut donc déjà reconnaître les siens.
Si l’adhésion a réussi, le pollen doit ensuite être réhydraté par le pistil afin de germer sous la forme d’un tube pollinique (figure 3). Les lipides du stigmate s’organisent alors localement de manière à laisser passer de l’eau en direction du pollen, qui va se « regonfler » pour adopter une forme fonctionnelle[4]. Il peut ainsi germer : la paroi pollinique se fissure et le contenu du grain forme un tube unicellulaire en croissance polarisée qui va s’allonger jusqu’à atteindre l’extrémité opposée du pistil, là où se trouvent les ovules (figure 4).

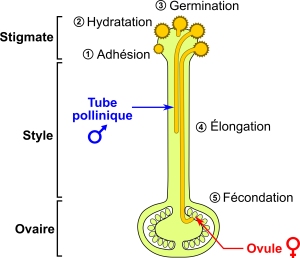
Ce phénomène est exceptionnel à plusieurs égards. D’abord, parce qu’une cellule unique va s’allonger rapidement sur plusieurs centaines ou plusieurs milliers de fois sa largeur sans se perdre dans le tissu. Ensuite, parce que cette cellule, dite végétative, renferme deux autres cellules « enclavées », dites génératives, qui vont ensemble féconder un ovule. Les mécanismes physiques sous-jacents à cette croissance font l’objet d’intenses recherches à l’Université de Montréal[5].
Si le tube pollinique dispose au départ de ses propres réserves énergétiques pour grandir, celles-ci viennent très vite à manquer. La femelle, qui lui avait déjà donné à boire, arrive alors à la rescousse pour lui fournir à manger. De nombreux canaux dans la membrane du pollen permettent en effet à ce dernier d’aspirer des nutriments synthétisés par la femelle, en particulier des sucres[6].
Leçon no 2. Orientez-les jusqu’à vous.
Il serait vain de nourrir le pollen sans lui fournir des indications pour s’orienter correctement dans le tissu femelle. En effet, le tube pollinique qui mesure quelques micromètres de largeur doit pouvoir trouver son chemin dans un pistil long de parfois plusieurs centimètres ! Pour ce faire, le tissu femelle lui envoie des signaux d’attraction, en particulier de petites protéines sécrétées. Ces dernières forment un gradient dans le pistil, c’est-à-dire qu’elles sont de plus en plus concentrées à mesure que l’on s’approche de l’endroit où elles ont été synthétisées. Ainsi, le pollen est capable d’orienter sa croissance en percevant ces signaux et leur concentration au moyen de récepteurs adéquats[7].
Si l’on connaît depuis un certain temps les signaux d’attraction du stigmate et du style, les médiateurs de guidage les plus étudiés à ce jour sont ceux sécrétés au voisinage immédiat de l’ovule[8]. En effet, à la différence de leurs homologues animaux qui sont tout simplement sphériques, les ovules végétaux sont des structures éminemment complexes dans lesquelles le tube pollinique doit trouver son chemin pour assurer la fécondation correcte de l’oosphère, la cellule sexuelle femelle qui donnera l’embryon (figure 5). Les deux cellules synergides qui encadrent l’oosphère sont nécessaires pour produire ce chimioattractant.
Le laboratoire de Daniel P. Matton, à l’Université de Montréal, cherche à identifier la nature de ces protéines chez les Solanacées, la famille des pommes de terre, de la tomate et du tabac. Des équipes de recherche travaillant sur d’autres familles de plantes ont montré le rôle important joué par des protéines de la famille des défensines. Ces petites molécules, d’abord caractérisées chez l’humain comme des médiateurs de défense contre les pathogènes – d’où leur nom – ont été également découvertes chez les plantes, où elles semblent jouer une multitude de rôles, dont le guidage du tube pollinique[9].
On a par exemple déjà identifié deux défensines contrôlant le guidage chez la plante d’ornement Torenia fournieri (vidéo 1). En l’absence de ces protéines, les tubes polliniques présentent une croissance désorientée et ne parviennent jamais à féconder l’ovule[10].
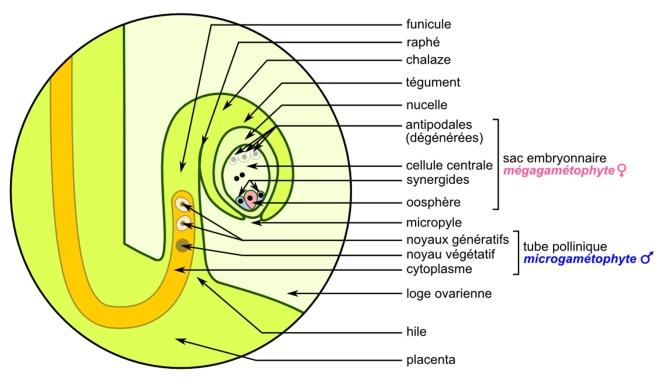
Une fois parvenu à proximité immédiate de l’ovule, le tube pollinique peut entrer en contact avec lui. Là encore, plusieurs protéines interagissent physiquement pour contrôler et, le cas échéant, amorcer la dernière étape de la reproduction : la fécondation[11]. Le tube pollinique éclate et libère ses deux noyaux spermatiques. Le premier va féconder l’oosphère pour donner une cellule-œuf qui se divisera en formant l’embryon. Le second va féconder la cellule centrale de l’ovule pour produire ce qui deviendra l’albumen, c’est-à-dire la réserve nutritive de la graine.
Leçon no 3. Choisissez les mâles qui vous vont le mieux.
Si la femelle a les moyens de favoriser la croissance des tubes polliniques et de les orienter correctement, elle veille aussi à placer des barrages sur leur route pour contrôler leur identité. Le succès de la reproduction sexuée dépend en effet de la distance génétique entre les partenaires sexuels, qui doit être ni trop faible, ni trop élevée.
Une distance trop faible entraîne ce que l’on appelle chez les animaux la consanguinité. En diminuant le brassage génétique, la consanguinité produit des individus de moins en moins adaptés à leur milieu : on parle de dépression endogamique[12]. Or, ce phénomène est particulièrement favorisé chez les plantes à fleurs. En effet, la plupart d’entre elles présentent des fleurs hermaphrodites, comportant à la fois des étamines et un pistil. Il s’ensuit qu’une grande partie des grains de pollen déposés sur le pistil proviennent de la même plante. S’ils parviennent à féconder un ovule, on obtient un individu « consanguin ».
Pour éviter ceci, environ la moitié des espèces végétales ont développé un mécanisme de protection dénommé auto-incompatibilité[13]. Comme son nom l’indique, cette fonctionnalité permet d’empêcher que le pollen issu de la même plante que le pistil féconde des ovules. Les travaux de plusieurs chercheurs de l’UdeM ont contribué à identifier les molécules impliquées dans ce phénomène chez les Solanacées, qui repose sur une région de l’ADN appelée locus S[14].
Lorsque le tube pollinique atteint le premier tiers du pistil, des molécules femelles appelées RNases S vont pénétrer à l’intérieur. Il s’agit d’enzymes dont l’activité conduit in fine à la mort du tube pollinique. Si le pollen en croissance provient d’une plante présentant une distance génétique suffisante avec le pistil, les RNases S seront bloquées et le pollen pourra continuer son chemin. Dans le cas contraire, les RNases S amorceront la mise à mort du pollen[15].
Un système similaire existe aussi dans la famille des roses (Rosacées) ou des gueules-de-loup (Scrophulariacées). En outre, des mécanismes différents aboutissant au même résultat ont été décrits dans les familles du chou (Brassicacées) et du pavot (Papavéracées). Il s’agit d’un atout majeur expliquant le maintien des plantes au fil de l’histoire évolutive[16].
Toutefois, en dehors de ces mariages consanguins, il arrive fréquemment que des plantes d’espèces différentes mais proches parviennent à se croiser et à produire un hybride. Du point de vue de l’espèce, ceci constitue un danger, car à force de croisements interspécifiques, l’identité particulière de chaque espèce est diluée jusqu’à disparaître. Pour éviter ceci, les plantes disposent de plusieurs barrières, qui reposent en partie sur les interactions entre pollen et pistil[17]. En effet, s’il parvient à germer, le pollen provenant d’une autre espèce est souvent ralenti dans le pistil, ou encore incapable de percevoir correctement les signaux d’attraction émis par les ovules.
Une des hypothèses avancées pour expliquer ceci est la divergence entre espèces des protéines impliquées dans toutes les interactions pollen-pistil que nous avons mentionnées plus haut. En effet, si pollen et pistil ne sont pas de la même espèce, ils ne parlent pas tout à fait la même langue, et ont donc de la difficulté à établir le dialogue moléculaire que nous avons évoqué plus haut. De fait, l’adhésion, la germination, la nutrition et l’orientation du pollen jusqu’aux ovules se trouvent mises en échec d’autant plus sévèrement que les partenaires sexuels sont distants l’un de l’autre[18].
Là encore, l’identification des acteurs moléculaires sous-jacents à cette préférence à l’espèce et la caractérisation de leur divergence évolutive sont des questions majeures auxquelles tentent de répondre les biologistes de l’Université de Montréal.
Conclusion
À la fois cruciale et encore mal connue, la communication entre le pollen et le pistil concentre aujourd’hui de nombreux travaux de recherche dans une dynamique interdisciplinaire. La question de la reproduction sexuée intéresse en effet tous les niveaux d’organisation du vivant, du gène à l’écosystème en passant par la cellule, le tissu et l’individu.
Les premières esquisses de ce dialogue moléculaire dressées par les biologistes témoignent de la richesse et de la complexité du monde végétal. Les plantes n’ont décidément pas fini de nous surprendre, et de nous en apprendre.
[1] BELL, Charles D., Douglas E. SOLTIS et Pamela S. SOLTIS. « The age and diversification of the angiosperms revisited », American Journal of Botany, vol. 98, no 8, août 2010, p. 1296-1303.
[2] GEITMANN, Anja et Ravishankar PALANIVELU. « Fertilization requires communication: Signal generation and perception during pollen tube guidance », Floriculture and Ornamental Biotechnology, vol. 1, no 1, août 2007, p. 77-89.
[3] ZINKL, Gregory M. et Daphne PREUSS. « Dissecting Arabidopsis pollen-stigma interactions reveals novel mechanisms that confer mating specificity », Annals of Botany, vol. 85, supplément 1, janvier 2000, p. 15-21.
[4] WOLTERS-ARTS, Mieke, Louise van der WEERD, Adriaan C. van AELST, Jaap van der WEERD, Henk van AS, et Celestina MARIANI. « Water-conducting properties of lipids during pollen hydration », Plant, Cell and Environment, vol. 25, no 4, avril 2002, p. 513-519.
[5] AGUDELO, Carlos G., Amir SANATI NEZHAD, Mahmood GANBARI, Masha NAGHAVI, Muthukumaran PACKIRISAMY, et Anja GEITMANN. « TipChip: a modular, MEMS-based platform for experimentation and phenotyping of tip-growing cells », The Plant journal, vol. 73, no 6, mars 2013, p. 1057-1068.
[6] WU, Hen-ming, Hong WANG et Alice Y. CHEUNG. « A pollen tube growth stimulatory glycoprotein is deglycosylated by pollen tubes and siplays a glycosylation gradient in the flower », Cell, vol. 82, no 3, août 1995, p. 395-403.
[7] CHAE, Keun et Elizabeth M. Lord. « Pollen tube growth and guidance : roles of small, secreted proteins », Annals of Botany, vol. 108, no 4, avril 2011, p. 627-636.
[8] TAKEUCHI, Hidenori et Testuya HIGASHIYAMA. « Attraction of tip-growing pollen tubes by the female gametophyte », Current opinion in plant biology, vol. 14, no 5, octobre 2011, p. 614-621.
[9] SILVERSTEIN, Kevin A. T., William A. MOSKAL Jr., Hank C. WU, Beverly A, UNDERWOOD, Michelle A. GRAHAM, Christopher D. TOWN, et Kathryn A. VANDENBOSCH. « Small cysteine-rich peptides resembling antimicrobial peptides have been under-predicted in plants », The Plant journal, vol. 51, no 2, juillet 2007, p. 262-280.
[10] TAKEUCHI, Hidenori et Testuya HIGASHIYAMA. « A species-specific cluster of defensin-like genes encodes diffusible pollen tube attractants in Arabidopsis », PLoS Biology, vol. 10, no 12, décembre 2012, p. e1001449.
[11] KESSLER, Sharon A. et Ueli GROSSNIKLAUS. « She’s the boss: signaling in pollen tube reception », Current opinion in plant biology, vol. 14, no 5, octobre 2011, p. 622-627.
[12] CHARLESWORTH, Deborah et John H. WILLIS. « The genetics of inbreeding depression », Nature Reviews Genetics, vol. 10, no 11, novembre 2009, p. 783-796.
[13] IGIC, Boris, et Joshua R. KOHN. « Bias in the studies of outcrossing rate distributions », Evolution, vol. 60, no 5, mai 2006, p. 1098-1103.
[14] MATTON, Daniel P., Olivier MAES, Geneviève LAUBLIN, Qin XIKE, Charles BERTRAND, David MORSE et Mario CAPPADOCIA. « Hypervariable domains of self-incompatibility RNases mediate allele-specific pollen recognition », The Plant cell, vol. 9, no 10, octobre 1997, p. 1757-1766.
[15] FRANKLIN-TONG, Vernonica E., et F. Chris H. FRANKLIN. « The different mechanisms of gametophytic self-incompatibility », Philosophical transactions of the Royal Society of London, Series B Biological sciences, vol. 358, no 1434, juin 2003, p. 1025-1032.
[16] IWANO, Megumi et Seiji TAKAYAMA. « Self/non-self discrimination in angiosperm self-incompatibility », Current opinion in plant biology, vol. 15, no 1, février 2012, p. 78-83.
[17] RIESEBERG, Loren H. et Benjamin K. BLACKMAN. « Speciation genes in plants », Annals of Botany, vol. 106, no 3, septembre 2010, p. 439-455.
[18] SWANSON, Robert, Anna F. EDLUND et Daphne PREUSS. « Species specificity in pollen-pistil interactions », Annual Reviews in Genetics, vol. 38, décembre 2004, p. 793-818







